Менопаузальный синдром
Что такое заместительная гормональная терапия?
Климактерический синдром
Урогенитальные растройства
Постменопаузальный остеопороз
Атеросклероз и ишемическая болезнь сердца
Стратегия заместительной гормональной терапии
С возрастанием продолжительности жизни особое медико-социальное значение приобретают разнообразные аспекты, которые определяют качество жизни женщин этого возраста. К их числу относятся проблемы, связанные с профилактикой, диагностикой и лечением патологических состояний, одним из существенных факторов патогенеза которых является дефицит эстрогенных влияний и которые становятся как бы "болезнями" эстрогенного дефицита. Это - нейро-вегетативные проявления климактерического синдрома, урогенитальные нарушения, заболевания сердечно-сосудистой системы, явления остеопороза. Несмотря на то, что патофизиологическая роль эстрогенного дефицита в развитии указанных системных изменений неоднозначна, результаты многочисленных научных изысканий в этой области позволили сформулировать концепцию о заместительной гормональной терапии и стимулировали создание широкого арсенала специальных гормональных препаратов и различных лекарственных форм, предназначенных для профилактики и лечения т.н. менопаузального синдрома.
К сожалению, однако, при появлении упомянутых выше симптомов женщины переходного возраста сравнительно редко обращаются за помощью к гинекологу и все чаще становятся пациентками врачей сопряженных клинических специальностей. В связи с этим роль эстрогенного дефицита в патофизиологии системных изменений при этих состояниях не всегда учитывается в должной степени, что отражается и на эффективности лечебных мероприятий. Указанные обстоятельства диктуют необходимость распространения соответствующей информации среди врачей различного профиля, соприкасающихся с проблемами геронтологии.
В Научном центре акушерства, гинекологии и перинатологии Российской Академии медицинских наук проблемы диагностики и лечения осложнений климактерического периода и постменопаузальных метаболических нарушений в течение многих лет служат предметом научных изысканий, на основе которых сформировались коллективы врачей и ученых, углубленно разрабатывающих эту проблему. Регулярно проводятся научные симпозиумы и учебные циклы по актуальным направлениям заместительной гормональной терапии при менопаузальном синдроме.
Данное руководство разработано для профессионального обучения врачей-гинекологов, терапевтов, эндокринологов, ортопедов-травматологов. Читатель найдет в нем краткое обобщение алгоритмов диагностики, лечения и профилактики заболеваний переходного периода жизни женщины, имеющих эстрогендефицитную природу, а также перечень показаний и противопоказаний для заместительной гормональной терапии.
Директор Научного Центра акушерства, гинекологии и перинатологии РАМН, академик Российской Академии медицинских наук В.И. Кулаков
Руководитель Сотрудничающего Центра Всемирной Организации Здравоохранения по репродукции человека, член-корреспондент Российской Академии медицинских наук. Е.М. Вихляева
Назад
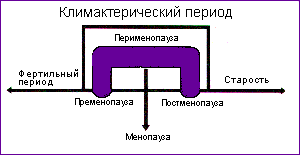
Рис. 1. Место климактерического периода в жизненном цикле женщины Как известно, старение организма является генетически запрограммированным процессом. Между тем, на протяжении последнего полуторавекового периода времени существенно изменилась продолжительность жизни женщины после наступления менопаузы (Рис.2). К концу XX столетия женщины проводят в состоянии эстрогенного дефицита почти треть своей жизни, что обуславливает возрастание значимости медицинских и социальных проблем этой возрастной группы населения для общества.
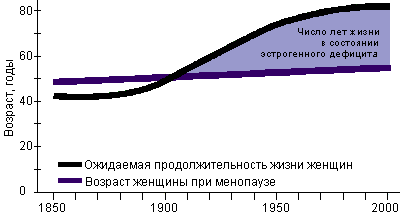
Рис. 2. Продолжительность жизни женщины в состоянии эстрогенного дефицита
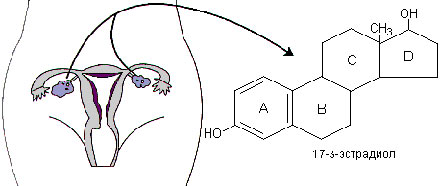
В яичниках женщин репродуктивного возраста секретируются все три вида эстрогенных гормонов - эстрон, 17бета-эстрадиол и эстриол (Рис.З).
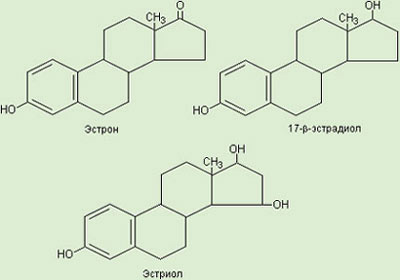
Рис. 3. Структурные формулы эстрогенов
Несмотря на определенное структурное сходство, степень выраженности их сродства к специфическим рецепторным белкам в органах-мишенях различна, также как и реализация центральных и периферических эффектов в организме женщины. Снижение уровня секреции эстрогенов в ткани яичников сопровождается повышением (по принципу обратной связи) образования ФСГ в гипофизе (Рис.4).
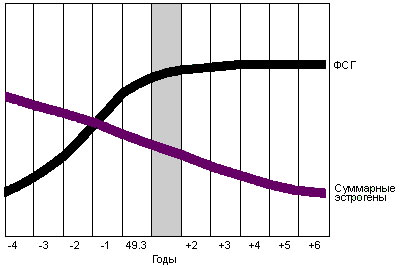
Наибольшей биологической активностью в организме женщины обладает 17бета-эстрадиол. Снижение его секреции в яичниках начинается приблизительно за 5 лет до прекращения менструации и вскоре после менопаузы достигает нулевых значении (Рис.5). Основным эстрогенным гормоном, циркулирующим в периферическом кровотоке в постменопаузе, является эстрон.
Уровни 17бета- эстрадиола, пмоль/л:
Пременопаузальный:
- ранняя фолликулиновая фаза - 284 (215-375)
- середина лютеиновой фазы - 438 (344-559)
Постменопаузальный: 71 (42-122)
В течение первого года после менопаузы уровень содержания ФСГ в плазме периферической крови возрастает в 13 раз, ЛГ - приблизительно в 3 раза, и, после дальнейшего повышения, происходит постепенное снижение уровня гонадотропинов. Спустя 30 лет после менопаузы его содержание соответствует 40-50% от максимальных значений постменопаузального периода, но превышает уровень репродуктивного возраста.
После угнетения функции яичников и прекращения продукции 17бета-эстрадиола основным источником образования эстрона становится периферическая конверсия андростендиона, образующегося в коре надпочечников и ткани яичников. Два эндогенных фактора могут способствовать повышению образования эстрона: это повышенная секреция его предшественников и/или усиление периферической их конверсии в связи с заболеваниями печени, ожирением, гипертекозом и опухолями стромы яичников.
К числу наиболее значимых последствий и клинических проявлении эстрогенного дефицита, оказывающих значительное влияние на качество жизни женщин пери- и постменопаузального возраста и объединяемых в понятие о т.н. менопаузальном синдроме, относятся вегето-невротические проявления (климактерический синдром), урогенитальные нарушения, дистрофические изменения кожи, высокий риск развития атеросклероза и ишемическои болезни сердца, остеопороз, психологические нарушения. Время появления и степень выраженности этих симптомов подвержены значительным индивидуальным колебаниям, но вместе с тем подчинены определенной хронологической закономерности в последовательности их проявления (Рис.6).

Рис. 6. Симптомы эстрогенного дефицита и возраст женщины: пунктир - продолжительность латентного периода, сплошная линия - период выраженных клинических проявлений
Защитный и лечебный эффект гормональных препаратов при перечисленных клинических проявлениях менопаузального синдрома послужил основанием для введения в клиническую практику заместительной гормональной терапии, стратегия которой зависит от степени риска и характера системных нарушений.
Приведенный в конце этого раздела перечень созданных для заместительной гормональной терапии лекарственных соединений позволяет ориентироваться в химической структуре эстрогенов и прогестинов и выбрать необходимые компоненты и дозовые режимы соответственно планируемому по продолжительности курсу лечения. Выбору способа лечения могут помочь также и представления о пути обменных превращений эстрогенных гормонов как основного лечебного фактора в зависимости от способа введения препарата. После перорального приема гормоны поступают в портальный кровоток и после прохождения через печень - в систему общего кровообращения. При чрескожном же пути введения распределение препарата в общем кровотоке предшествует метаболическим его превращениям в печени (Рис.7). Соответственно особенностям обменных превращений при разных способах введения гормональных препаратов различается и биодоступность последних, которая высока при чрескожном пути введения и относительно низка при пероральном приеме.
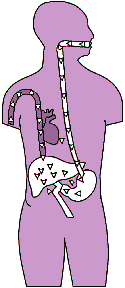
Рис. 7. Всасывание и пути обменных превращений эстрогенных гормонов при оральном и чрескожном их введении
Чрескожно:
- Доза эстрадиола, мкг
- Эстрадиол в плазме > эстрона
- Эффект первого прохождения отсутствует
- Высокая биодоступность
Перорально:
- Доза эстрадиола, мг
- Эстрон в плазме > эстрадиола
- Эффект первого прохождения
- Низкая биодоступность
Принципы заместительной гормональной терапии в перименопаузальном периоде основываются на последовательном назначении эстрогенов и прогестинов в циклическом режиме для облегчения климактерических симптомов и поддержания регулярных циклов. После менопаузы желательно избежать менструальноподобных выделении; целью лечения в этом периоде является устранение симптомов климактерического синдрома, улучшение качества жизни в физическом и психическом отношении и предупреждение развития остеопороза и ишемическои болезни сердца. В связи с этим в постменопаузальном периоде предпочтение отдается назначению гормональных препаратов в непрерывном режиме. При выраженных признаках старения урогенитальной системы средством выбора являются эстрогены, обладающие специфической кольпо- и уротропной активностью - эстриол и его аналоги. При назначении заместительной гормональной терапии пациенткам с локальными урогенитальными нарушениями преследуется цель восстановления нормального функционального состояния гормонзависимых тканей урогенитальной системы и стимуляции механизмов естественной биологической защиты в нижних отделах мочеполовой системы.
Стратегия заместительной гормональной терапии предусматривает выбор наиболее низкого, но обязательно адекватного дозового режима с учетом настоятельной необходимости предупреждения пролиферативного воздействия на эндометрии и молочные железы путем непременного использования прогестинов в циклическом или непрерывном режиме.
Длительность курса заместительной гормональной терапии (ЗГТ) вариабельна и зависит от времени развития и характера клинических проявлений менопаузального симптомокомплекса. Непродолжительные курсы ЗГТ с положительным эффектом могут быть использованы у женщин с приливами жара, психологическими нарушениями, диспареунией, при нарушениях мочеиспускания. При выраженных системных нарушениях и в целях предупреждения их развития у женщин в группах риска продолжительность ЗГТ составляет обычно 6-8 лет. В этих условиях осуществляется защитный эффект эстрогенов в части благоприятного влияния на липидный спектр крови и толерантность к глюкозе. Предотвращается развитие атеросклероза, и риск развития нарушений со стороны сердечно-сосудистой системы снижается с 65 до 33%.
При использовании чрескожной системы благоприятные сдвиги в липидном спектре крови наступают после 6 месяцев лечения; одновременно снижается АД и уменьшается риск развития остеопороза; отсутствуют изменения со стороны свертывания крови.
При проведении заместительной гормональной терапии могут быть использованы различные лекарственные соединения, различные пути введения и дозовые режимы. В связи с необходимостью реализации защитного эффекта прогестагенов по отношению к гормонозависимым структурам на фоне применения эстрогенных гормонов все чаще применяются комбинированные препараты.
До настоящего времени наибольшее распространение получил прием внутрь таблетированных форм комбинированных препаратов, созданных на основе ежедневного приема эстрогенов с включением прогестагенов на вторую половину каждого лечебного цикла (двухфазные или трехфазные препараты).
| Климен | Эстрадиола валерат (Е2 вал.) 2 мг
Е2 вал. 2 мг+Ципротерона ацетат 1 мг | 11 дней
10 дней |
| Климонорм | Эстрадиола валерат (Е2 вал.) 2 мг
Е2 вал. 2 мг+Левоноргестрел 0,15 мг | 9 дней
12 дней |
| Циклопрогинова | Эстрадиола валерат (Е2 вал.) 1-2 мг
( Е2 вал.) 1-2 мг+Норгестрел 0,5 мг | 9 дней
12 дней |
| Дивина | Эстрадиола валерат (Е2 вал.) 1-2 мг
(Е2 вал.) 1-2 мг+Медроксипрогестерона ацетат 10 мг | 11 дней
10 дней |
| Трисеквенс | 17-бета-эстрадиол(17-бета Е2) 2мг
17-бета Е2 2 мг+Норэтистерона ацетат 1 мг 17-бета-эстрадиол 1 мг | 12 дней
10 дней 6 дней |
| Эстрофем | 17-бета-эстрадиол 2мг | 28 дней |
Комбинация эстрогенов и прогестагенов используется также в депонированной форме для ежемесячных внутримышечных инъекции:
Эстрадиола валерат 4 мг
+Дегидроэпиандростерона энанат 200 мг
Конъюгированные эстрогены обычно назначаются в дозе 0,625 мг/день с перерывами в приеме препаратов на 2-3 последних дня каждой недели или непрерывно с дополнением Левоноргестрела (75 мкг/день) на 12 последних дней каждого лечебного цикла.
В непрерывном режиме могут быть также назначены:
| Тиболон
(Ливиал) | 2,5 мг/день |
17-бета-эстрадиол
| 2 мг
|
Местно применяются влагалищные таблетки и суппозитории (0,25 мг, 0,5 мг эстриола) или влагалищные кремы с аппликаторами.
При выборе чрескожного пути введения могут быть использованы две модификации трансдермальных систем - с высвобождением или одного эстрогенного, или и эстрогенного, и прогестагенного компонентов. При этом высвобождается 25, 50 или 100 мкг 17-бета-эстрадиола в сутки.
Назад
В патогенезе климактерического синдрома существенную роль играют изменения функционального состояния гипоталамических структур и нарушения вегетативного равновесия вследствие нарушении в выработке нейротрансмиттеров (норадреналина и дофамина), участвующих в процессе терморегуляции. Повышение тонуса норадренергических и дофаминергических структур центральной нервной системы обуславливает пароксизмальное расширение кожных сосудов и появление феномена прилива жара.
Прилив жара сопровождается повышением уровня ЛГ и ТТГ при отсутствии изменении в уровне содержания ФСГ, пролактина и тиреоидных гормонов в плазме периферической крови. У больных с КС сохранены суточные ритмы секреции ТТГ со значительным повышением его уровня в ночное время, что способствует учащению приливов жара в это время суток. Поддержание постоянно высокого уровня активных фракций тиреоидных гормонов способствует повышению чувствительности периферических тканей к катехоламинам, что и вызывает характерные вазомоторные реакции.
Ощущение жара возникает вследствие центральной гипертермии и появляется спустя 30-60 секунд после обнаружения спастического состояния в артериальных коленах капилляров кожи при капилляроскопическом исследовании. Различные по степени тяжести проявления КС встречаются у 40-60% женщин старше 40 лет. Первые его признаки возникают чаще в 45-50 лет, на рубеже пре- и постменопаузы. Кривая появления приливов жара носит волнообразный характер соответственно сезонным изменениям функционального состояния гипоталамических структур. Первые симптомы заболевания появляются чаще в весеннее (февраль-март) или осеннее (сентябрь-октябрь) время года.
Почти у половины женщин с КС отмечается тяжелое течение заболевания (51%), у каждой третьей (33%) его проявления носят умеренный характер и только в 16% КС сопровождается легкими проявлениями (Рис.8).
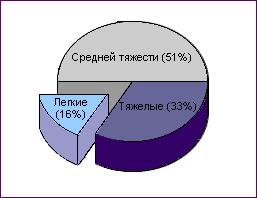
Рис. 8. Распределение женщин с климактерическим синдромом по степени тяжести клинических проявлений
Более легкое и менее продолжительное течение КС встречается, как правило, у практически здоровых женщин, тогда как у больных с хроническими психосоматическими заболеваниями КС протекает атипично, имеет наклонность к продолжительному течению. Вегетоневротические проявления имеют наклонность к кризовому течению, нарушают общее состояние здоровья больных на длительное время и иногда служат причиной экстренной их госпитализации. Больные нередко оказываются резистентными к разнообразным лечебным воздействиям.
Отмечено, что только у 18% больных острые проявления КС исчезают в течение первого года с момента их появления; в 56% случаев заболевание продолжается в пределах 1-5 лет, а у каждой четвертой женщины с КС (26%) заболевание имеет еще более длительное течение (Рис.9).
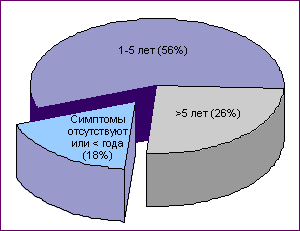
Рис. 9. Распределение пациенток с климактерическим синдромом по продолжительности заболевания
Диагноз
Климактерический синдром относится к пограничным состояниям клинической медицины и поэтому больные нуждаются в комплексном обследовании врачами ряда специальностей. Вместе с тем, первое слово в диагнозе остается за гинекологом, так как появляющиеся симптомы связаны прежде всего с угасанием функции яичников. Больные нуждаются в специальном обследовании для уточнения гормональной активности яичников, определения уровня эстрогенных влияний и выявления связи между появлением приливов жара и климактерическими изменениями менструальной функции. Ведущая роль врача-гинеколога в лечении больных с КС обусловлена также необходимостью выбора метода лечебного воздействия, препарата для заместительной гормональной терапии, соответствующих гормональных компонентов и дозового режима соответственно меняющимся в ходе возрастной инволюции организма гормональным соотношениям. Вместе с тем, каждая больная с климактерическим синдромом нуждается и в специальном терапевтическом, а иногда и в психоневрологическом обследовании.
В ходе диагностического обследования решению вопроса о выборе метода лечебного воздействия помогает определение модифицированного менопаузального индекса (ММИ) по шкалам нейровегетативных, эндокринно-метаболических и психоэмоциональных нарушении (Табл.1).
Таблица 1
Менопаузальный индекс
Симптомы,баллы |
1 |
2 |
3 |
|
Нейровегетативные | |||
Повышенное АД, мм Нg
| 150/90
| 160/100
| 160/100
|
|
Метаболические/эндокринные | |||
Ожирение, степень
| 1
| 2
| 3
|
|
Психоэмоциональные | |||
Утомляемость
| +
| ++
| +++
|
С помощью же балльной шкалы оценки степени тяжести КС (Табл.2) удается уточнить показания для назначения заместительной гормональной терапии.
Таблица 2
Шкала оценки модифицированного менопаузального синдрома
Симптомы,баллы |
Степень выраженности | ||
Слабая | Умеренная | Тяжелая | |
Нейро-вегетативные | > 10-20 | 21-30 | > 30 |
Метаболические | 1-7 | 8-14 | > 14 |
Психо-эмоциональные | 1-7 | 8-14 | > 14 |
ММИ | 12-34 | 35-58 | >= 58 |
Вместе с тем окончательное решение о назначении заместительной гормональной терапии может быть принято лишь при соблюдении принципов максимальной онкологической настороженности с полной ориентацией в состоянии гормончувствительных органов-мишеней, прежде всего эндометрия, яичников и молочных желез.
При возникновении показаний к лечению следует приступать своевременно, не позже первых 6-12 месяцев с момента появления приливов жара, т.к. на начальных этапах заболевания основные его симптомы легче подвергаются обратному развитию. Одновременно удается предотвратить развитие тяжелых форм КС.
Лечение
Развиваясь в процессе возрастной перестройки организма, клинические проявления климактерического синдрома нередко подвергаются спонтанному обратному развитию, в связи с чем необходимость в специальном лечении возникает не у каждой женщины с этой патологией. Показаниями к назначению заместительной гормональной терапии служат тяжелые и средней тяжести проявления заболевания, вопрос же о лечении больных с легкими формами решается в процессе динамического наблюдения. Общеукрепляющее лечение женщин с данным синдромом является частью рационального гигиенического режима, рекомендуемого для лиц пожилого возраста. Аналогичные мероприятия рекомендуются и для профилактики климактерического синдрома. Рекомендуется регулирование диетического режима, включение в пищевой рацион овощей, фруктов и витаминных препаратов для пополнения естественного дефицита витаминов в пожилом возрасте. При этом следует учитывать эффект витамина А, обусловленный антигистаминными его свойствами и способностью ускорять внутриклеточные окислительные процессы, витамина С - воздействовать на нарушенный липидный обмен, витамина Е - способствовать улучшению капиллярного кровообращения в области гипофиза, а также оказывающего коферментативный эффект, с усилением синтеза холестерина и стероидных гормонов. При разработке и рекомендации диеты следует учитывать возрастные метаболические сдвиги в женском организме, в частности, выключение "защитного" эффекта эстрогенов с соответствующими изменениями толерантности к углеводам и жирам, повышение содержания сывороточного холестерина, триглицеридов и фосфолипидов. Рекомендуется лечебная физкультура.
Значительно труднее и более длительно проходит лечение больных с давностью заболевания КС свыше 1-2 лет. На этой стадии его развития становятся более значительными и глубокими изменения динамики возбудительного и тормозного процессов в коре больших полушарий; происходит ослабление внутреннего активного торможения. В зависимости от времени начала лечения "выздоровление" больных наступает при различной степени компенсации возрастных системных нарушений, в первую очередь со стороны центральной нервной системы.
Клинический эффект заместительной гормональной терапии, даже при тяжелых формах КС, проявляется уже в первые месяцы лечебного воздействия. Так, при внутримышечном введении 1 раз в месяц депо - препарата (4 мг эстрадиола валерата + 200 мг дегидроэпиандростерона энантата) при тяжелом климактерическом синдроме благоприятный клинический эффект со снижением показателей ММИ в 5-6 раз отмечается одновременно со снижением уровня ЛГ и ФСГ в плазме периферической крови при отсутствии значимых изменений в индексе созревания влагалищного эпителия (Рис.10).
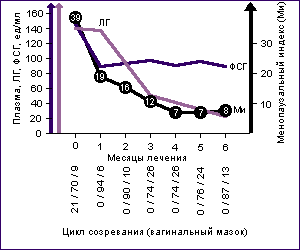
Рис. 10. Влияние заместительной гормональной терапии на показатели менопаузального индекса (ММИ), содержание ФСГ и ЛГ и индекс созревания влагалищного эпителия при тяжелой форме климактерического синдрома
При тяжелой форме КС уже спустя 6 месяцев после начала лечения существенно возрастает число пациенток, не предъявляющих жалобы на приливы жара, потливость, депрессию, затруднения в концентрации внимания, головные боли, сердцебиения, головокружения. У остальных же в ходе обратного развития КС большая часть этих симптомов приобретает легкое течение. Одновременно проявляется благоприятный эффект на липидный спектр крови и состояние сердечно-сосудистой системы.
Выбор метода гормонального воздействия основывается на совокупности симптомов менопаузального синдрома к моменту начала лечебного воздействия, отсутствии или сохранении менструально-подобных кровотечений, что позволяет прогнозировать продолжительность заместительной гормональной терапии - кратковременную или, наоборот, длительную, и определить конечную ее цель - лечение больных по поводу только КС или, одновременно, лечебное воздействие при комплексе развившихся в пери- и/или постменопаузе системных нарушений. Заместительная гормональная терапия может быть также назначена в постменопаузальном возрасте женщинам группы риска системных нарушении.
Назад
Частота возрастных урогенитальных расстройств весьма велика и среди женской популяции составляет 30%. Однако, если в перименопаузальном периоде они развиваются у 10% женщин, то в 55-60 лет - у 50%. Таким образом, у каждой второй женщины переходного возраста качество жизни значительно нарушается из-за урогенитальных расстройств. Частота последних повышается с возрастом и после 75 лет превышает 80% в связи с прогрессированием возрастных атрофических изменений.
По данным эпидемиологического исследования, симптомы урогенитальных расстройств среди жительниц г. Москвы встречаются в пери- и постменопаузе со следующей частотой:
- сухость и зуд во влагалище - 78%
- дизурические явления и недержание мочи - 68%
- диспареуния -26%
- рецидивирующие влагалищные инфекции - 22%.
Из общего числа женщин с различными климактерическими расстройствами женщины с урогенитальными нарушениями реже всего обращаются к гинекологу. Лечение их проводится обычно урологами и, как правило, безуспешно. Заместительная гормональная терапия практически не применяется.
Высокая чувствительность различных структур нижних отделов мочевыделительной и половой систем к эндо- и экзогенным эстрогенным влияниям обусловлена их эмбриологической общностью: влагалище, уретра, мочевой пузырь и нижняя треть мочеточников развиваются из урогенитального синуса.
Рецепторы к эстрогенам обнаружены:
- в слизистой оболочке и мышечных слоях стенки влагалища;
- эпителиальной, мышечной, соединительно-тканной и сосудистой структурах уретры;
- слизистой и мышцах-детрузорах мочевого пузыря;
- мышцах тазового дна;
- круглой маточной связке;
- соединительно-тканных структурах малого таза.
Атрофический вагинит
Атрофический вагинит характеризуется резким истончением слизистой влагалища, прекращением пролиферативных процессов во влагалищном эпителии. Клинически это проявляется сухостью влагалища, зудом, диспареунией. У здоровых женщин репродуктивного возраста значения рН влагалищного содержимого находятся в пределах 3,5-5,5, что обеспечивается лактобациллами, превращающими глюкозу в молочную кислоту. Последняя образуется из гликогена, находящегося в клетках многослойного плоского эпителия, попадающих после слущивания в просвет влагалища. Лактобациллы, кроме молочной кислоты, продуцируют другие антибактериальные компоненты, включая перекись водорода. Лактобациллы, низкий показатель рН, а также иммуноглобулины, продуцируемые парауретральными железами, являются своеобразной защитой от рецидивирующей влагалищной инфекции (защитная экологическая среда). Таким образом, нормальная микробная флора влагалища зависит от содержания гликогена в эпителиальных клетках, числа лактобацилл, рН, уровня эстрогенов, а также половой жизни.
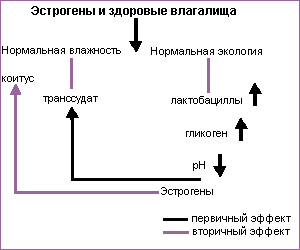
Таблица 3
На фоне дефицита эстрогенов в постменопаузе продукция гликогена в эпителиальных клетках снижается, количество лактобацилл значительно уменьшается или полностью исчезает. Вследствие этого возрастает рН влагалищного содержимого, что способствует снижению защитных его свойств и появлению во влагалище разнообразной аэробной и анаэробной патогенной флоры. (Табл. 3).
Диагностика атрофического вагинита включает:
- Жалобы больной:
- сухость и зуд во влагалище;
- затруднения при половой жизни;
- неприятные выделения;
- часто повторяющиеся кольпиты.
- Кольпоскопическое исследование - при расширенной кольпоскопии определяется истончение слизистой влагалища, кровоточивость, субэпителиальная сосудистая сеть.
- Кольпоцитологическое исследование - определение КПИ - кариопикнотического индекса (отношение числа поверхностных ороговевающих клеток с пикнотическими ядрами к общему числу клеток); индекса созревания (ИС - число парабазальных/промежуточных/поверхностных клеток на 100 подсчитанных). При развитии атрофических процессов во влагалище КПИ снижается < 15-20, ИС оценивается по сдвигу формулы: сдвиг формулы влево означает атрофию влагалищного содержимого, вправо - возрастание его зрелости, что происходит под действием эстрогенов. Исследование уроцитограммы.
- Определение рН проводится с помощью рН индикаторных полосок, которые прикладывают к верхней трети стенки влагалища на 1 мин. У здоровых женщин рН находится в пределах 3,5 и 5,5. Значения вагинального рН у нелеченых постменопаузальных женщин составляют 5,5-6,8 в зависимости от возраста и степени сексуальной активности. Чем выше рН, тем выше степень атрофии влагалищного эпителия.
Определение рН может служить скринингом для определения степени выраженности атрофических изменении во влагалище, для контроля за эффективностью лечебных воздействий, в качестве скринингого теста и мониторирования местного эффекта заместительной гормональной терапии. В репродуктивном возрасте рН влагалищного содержимого < 4,6, при умеренной атрофии влагалищного эпителия 5,1-5,8, при высшей степени атрофии - > 6,1.
Влияние эстрогенного дефицита на сексуальную активность женщин в постменопаузе
Сексуальная функция представляет собой комбинацию различных биологических, межперсональных и социально-культурных факторов. До наступления менопаузы у большинства людей устанавливается структура сексуального поведения, в котором сбалансированы сексуальные желания, активность и ответ. Происходящие в перименопаузе физиологические изменения часто снижают сексуальную активность женщины из-за диспареунии, недержания мочи, отсутствия сексуального желания и оргазма. В результате этой сексуальной дисфункции в последней трети жизни могут развиваться психологические расстройства, депрессии, приводящие к семейным конфликтам.
Яичниковые гормоны - эстрогены, прогестерон, андрогены играют интегральную роль в сексуальном желании, поведении и физиологии. Сексуальное значение эстрогенов у женщин заключается в предотвращении атрофических процессов во влагалище, усилении кровообращения в вульве и влагалище, поддерживании периферического сенсорного восприятия, а также благотворного влияния на ЦНС.
Причины изменений сексуальной активности в постменопаузе:
- снижение кровоснабжения вульвы и влагалища;
- потеря тонуса уретрой;
- недостаток увеличения размеров молочных желез во время сексуальной стимуляции;
- отставание по времени клиторической реакции;
- уменьшение или отсутствие секреции больших вестибулярных желез;
- уменьшение влагалищного транссудата;
- атрофические изменения во влагалище и развитие диспареунии. (Рис. 11).

Рис. 11. Состояние влагалищного эпителия у женщин репродуктивного и постменопаузального возраста
Наиболее частые специфические жалобы постменопаузальных женщин:
- снижение сексуального желания - 77%;
- сухость и зуд во влагалище - 58%;
- диспареуния - 39%;
- снижение частоты / интенсивности оргазма - 30%.
- Уродинамические нарушения в постменопаузе
Одним из самых частых симптомов, нарушающих здоровье, качество жизни и способствующих развитию восходящей урологической инфекции являются уродинамические нарушения.
Чаще всего встречаются:
- никтурия - частые ночные позывы к мочеиспусканию, нарушающие режим сна;
- частые мочеиспускания;
- безотлагательность позыва с недержанием мочи или без;
- стрессорное недержание мочи (недержание мочи при физической нагрузке: кашле, чихании, смехе, резких движениях и поднятии тяжестей);
- гиперрефлексия ("раздраженный мочевой пузырь") - частые позывы при незначительном наполнении мочевого пузыря;
- неполное опорожнение мочевого пузыря;
- дизурия - болезненные, частые мочеиспускания.
Все структуры и механизмы, участвующие в процессе удержания мочи, являются эстроген-зависимыми. Для удержания мочи давление в уретре должно постоянно превышать давление в мочевом пузыре. Это давление поддерживается 4-мя функциональными слоями уретры:
- Эпителием (имеет строение, аналогичное влагалищному);
- Соединительной тканью;
- Сосудистой сетью;
- Мускулатурой (Рис. 12).

Диагноз
- Жалобы больной - нарушения мочеиспускания вплоть до недержания, четко связанные с наступлением менопаузы.
- Прокладочный тест - определяется вес прокладки до и после часа физических упражнений. Возрастание веса прокладки более, чем на 1 г свидетельствует о недержании мочи.
- Бактериологическое исследование посева мочи и определение чувствительности к антибиотикам.
- Уродинамическое обследование:
- урофлоуметрия - объективная оценка мочеиспускания, дает представление о скорости опорожнения мочевого пузыря;
- цистометрия - регистрация взаимосвязи объема пузыря и давления в нем во время наполнения; метод определяет состояние мышц-детрузоров (стабильность/ нестабильность); дает представление об остаточной моче, величине внутрипузырного давления;
- профилометрия - графическое изображение давления в уретре по всей ее длине в состоянии покоя или при наполненном мочевом пузыре; метод имеет практическое значение при выявлении возможных причин недержания мочи.
Лечение
Лечение урогенитальных расстройств, связанных с возрастным дефицитом эстрогенов, и улучшение качества жизни невозможно без применения заместительной гормональной терапии. Эстрогены оказывают положительное влияние на все структуры урогенитального тракта в связи с наличием в последних эстрогеновых рецепторов у 60-70% женщин вне зависимости от многофакторности причин нарушений мочеиспускания (у многорожавших женщин, при врожденной слабости мышечных структур мочевыводящих путей, в связи с хирургическими вмешательствами).
Назначение эстрогенов способствует восстановлению экологии влагалища, препятствует развитию рецидивирующей вагинальной и мочевой инфекции и играет важную роль в лечении недержания мочи, особенно стрессорного и связанного с нестабильностью мышц-детрузоров. Перечисленные факторы способствуют не только удерживанию в уретре оптимального давления, но и препятствуют восходящей урологической инфекции в результате возникновения зоны повышенного давления в средней части уретры, которая действует как механический барьер, и секреции иммуноглобулинов парауретральными железами и слизи эпителием уретры.
В результате проксимальная часть уретры остается стерильной до тех пор, пока давление в уретре превышает давление в мочевом пузыре и в ее просвете находится достаточное количество слизи. Эти механизмы являются защитным экологическим барьером.
Процесс удержания мочи зависит также от тонуса мышц тазового дна, состояния коллагеновых волокон в связочном аппарате малого таза, а также мышц-детрузоров мочевого пузыря.
Оптимальная функция уретры тесно связана и со структурами вне уретры: лобково-уретральными связками, субуретральной стенкой влагалища, лобково-копчиковыми мышцами и мышцами-леваторами. Очень важным фактором является состояние в этих структурах
Биологический эффект эстрогенов при урогенитальных расстройствах, вне зависимости от способа применения, включает в себя:
- пролиферацию влагалищного эпителия с увеличением КПИ и ИС (Рис. 13);
- увеличение количества лактобацилл, гликогена и снижение рН влагалищного содержимого;
- улучшение кровоснабжения стенки влагалища, увеличение транссудации в просвет влагалища;
- улучшение кровоснабжения всех слоев уретры, восстановление ее мышечного тонуса, пролиферацию уретрального эпителия и увеличение количества уретральной слизи;
- повышение давления в средней части уретры до величин, превышающих давление в мочевом пузыре, что препятствует развитию стрессорного недержания мочи;
- улучшение трофики и сократительной активности мышц- детрузоров мочевого пузыря;
- улучшение кровообращения, трофики и сократительной активности мышц и коллагеновых волокон тазового дна;
- стимулирование секреции иммуноглобулинов парауретральными железами, что вместе с увеличением количества уретральной слизи создает биологический барьер, препятствующий развитию восходящей мочевой инфекции.

Рис. 13. Влияние эстриола (0,5 мг/день) на кольпоцитологическую картину у больной с сенильным кольпитом:
а) до лечения
б) после трехнедельного курса лечения
Выбор вида заместительной гормональной терапии, также как и лекарственной формы эстрогенов при их изолированном или комбинированном с прогестагенами применении диктуется патофизиологическими особенностями постменопаузальных системных изменений. При преобладании урогенитальных симптомов синдрома постменопаузы предпочтительны препараты эстриола, обладающего способностью оказывать специфический эффект на гормонозависимые структуры нижних отделов мочеполовой системы и не обладающего стимулирующими по отношению к эндометрию свойствами. Выбор лекарственной формы (таблетки, влагалищные кремы, суппозитории) в значительной степени определяется индивидуальной приемлемостью способа введения.
Наряду с назначением препаратов эстриола при генуинных возрастных урогенитальных расстройствах, они применяются успешно до и после влагалищных операций.
Назначение эстриола не требует дополнительного применения прогестагенов.
Назад
У взрослых индивидуумов минеральный состав костной ткани определяется воздействием нескольких факторов: наследственности, двигательной активности, диетических привычек и гормонального статуса. Спустя несколько лет после достижения пика массы костной ткани к 30-35 годам начинается ее потеря, которая является универсальным феноменом биологии человека, происходящим вне зависимости от пола, расовой принадлежности, профессии, привычной активности, особенностей экономического развития, географической зоны проживания и исторической эпохи. Средняя потеря костной ткани у женщины составляет примерно 1% в год по отношению к уровню пика массы костной ткани в репродуктивном возрасте. Ускорение этого процесса происходит в пределах первых пяти лет после менопаузы.
Первичный или инволюционный остеопороз - это системное поражение скелета у лиц пожилого возраста (50 лет и старше).
Первичный
Первичный остеопороз патогенетически развивается в виде двух клинических вариантов:
- постменопаузальный;
- старческий или сенильный.
Факторы риска первичного остеопороза нередко наследственно обусловлены, а также связаны с особенностями семейного и/или личного анамнеза:
- пожилой возраст;
- изящные, небольшого роста женщины с хрупким телосложением и светлой кожей, особенно из числа жительниц стран Северной Европы и Азии;
- указания на переломы в семейном анамнезе;
- позднее менархе (после 15 лет);
- ранняя менопауза (до 50 лет);
- олиго- или аменорея в репродуктивном возрасте;
- ановуляция и бесплодие;
- более 3-х беременностеи и родов в репродуктивном возрасте;
- длительная лактация (более 6 месяцев).
Вторичный
Вторичный остеопороз - это мультифакториальное заболевание, в возникновении которого играют роль следующие факторы:
- эндокринные (гипертиреоз, гипопаратиреоз, гиперкортицизм, диабет, гипогонадизм);
- недостаточность питания и дефицит кальция в пищевом рационе;
- избыточный прием алкоголя, никотина, кофе (более 5 чашек в день);
- длительный прием (свыше 4 недель) кортикостероидов, гепарина, антиконвульсантов;
- генетические факторы: неполный остеогенез, низкая пиковая масса кости;
- другие факторы: хроническая почечная недостаточность, снижение абсорбции кальция в кишечнике, длительная иммобилизация, гиподинамия.
Частота первичного остеопороза в развитых странах составляет 25-40% с преобладанием этого заболевания среди женщин белой расы. К 70-летнему возрасту 40% белых женщин имеют в анамнезе не менее одного перелома, обусловленного остеопорозом. Среди черных африканских женщин частота остеопороза составляет 11-12%. Среди жительниц г. Москвы остеопороз поясничных позвонков в популяции женщин 50-ти и более лет выявлен у 23,6%. Частота же костных переломов у женщин в возрастной группе 50-54 года возрастает в 4-7 раз в сравнении с мужчинами аналогичного возраста и продолжает повышаться в более старших возрастных группах. Среди женщин, перенесших костные переломы, остеопороз обнаруживается в 70% случаев.
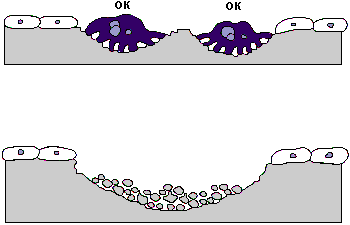
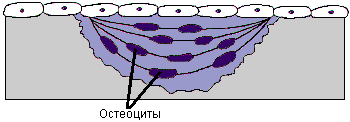
В костной ткани постоянно происходят процессы формирования и резорбции. В процессах ее формирования лидирующую роль играют остеобласты, резорбции - остеокласты (Рис.14).
Рис. 14. Схема ремоделирования костной ткани.
Ремоделирование кости

Активация
Резорбтивная фаза
Фаза созидания
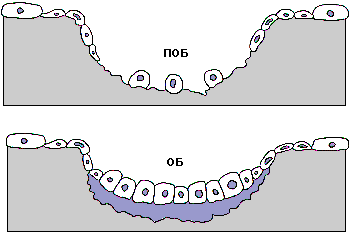
Фаза покоя
ПОБ: незрелые остеобласты
ОБ: остеобласт
ОК: остеокласт
В периоде достижения пиковой массы костной ткани процессы формирования преобладают над процессами резорбции. Потеря костной массы в менопаузе сопровождается в первую очередь поражением костей с преобладанием губчатого вещества (тела позвонков, дистальные отделы костей предплечья и пр. (Рис.15). Сенильный остеопороз развивается после 70 лет и характеризуется преимущественным поражением трубчатых костей с учащением переломов шейки бедра. При одинаковом темпе потери костной ткани степень выраженности ее дефицита у женщин пожилого возраста в первую очередь зависит от величины пиковой ее массы. Дефицит половых гормонов в климактерии может оказывать и прямое, и опосредованное влияние на состояние костной ткани.
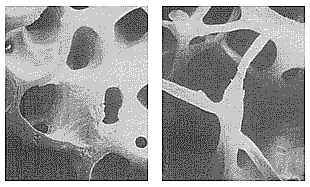
Рис. 15. Постменопаузальный остеопороз
ПАТОГЕНЕЗ
Для патогенеза остеопороза при эстрогендефицитных состояниях характерно:
- повышение чувствительности к паратгормону вследствие увеличения содержания в костной ткани рецепторов к паратгормону и усиление резорбции;
- снижение уровня кальцитонина, стимулирующего синтез кальцитриола в почках и, соответственно, снижение всасывания Са;
- повышение экскреции Са с мочой;
- снижение всасывания Са в кишечнике;
- снижение гидроксилирования витамина Д в почках;
- недостаточное поступление Са в костную ткань.
Прямой эффект экзо- и эндогенных половых гормонов (эстрадиола, прогестерона и тестостерона) на костную ткань осуществляется посредством связывания их со специфическими рецепторами на остеобластах. Таким образом, губчатое вещество костной ткани является своеобразным органом-мишенью для половых гормонов.
Процессы формирования и резорбции костной ткани связаны также и с влиянием ряда местных факторов, могущих оказывать ингибирующее и стимулирующее воздействие на остеобласты и остеокласты. Так, пролиферация, дифференцировка и общая активность остеобластов (синтез коллагена, образование костного матрикса) стимулируются трансформирующим ростовым фактором, инсулиноподобными факторами роста (соматомединами), альфа-микроглобулином, остеопектином и другими факторами. Стимуляция пролиферации, дифференцировки и резорбтивной активности остеокластов осуществляется простагландинами Е2, интерлейкинами-1 и -6, вазоактивным интестинальным пептидом, интерфероном, фактором некроза опухолей, лимфотоксинами, макрофагальным колонизирующим фактором и др. Возрастная потеря части губчатого слоя нарушает структуру кости и способствует возникновению переломов.
Общепринятая гипотеза о механизме развития остеопороза основана на представлении о защитном эффекте эстрогенов по отношению к костной ткани. Снижение уровня эстрогенных влияний различной этиологии делает костную ткань более чувствительной к рассасывающему влиянию паратгормона и/или витамина Д3. Защитный эффект эстрогенов реализуется через кальцитонин, секреция которого стимулируется эстрогенами. В связи с этим в постменопаузе возрастает потребность в Са, для поддержания баланса которого необходимо восполнение суточной потребности в объеме от 500 до 1500 мг. В соответствии с изменениями плотности костной ткани при снижении ее на 10% риск переломов позвоночного столба и проксимальной части бедренной кости возрастает в 2-3 раза. Снижение плотности губчатого вещества позвонков в ранней постменопаузе находится в прямой связи с первоначальным объемом костной ткани: чем выше плотность последней, тем больше величина абсолютной потери. Особенно велика потеря костной ткани в ранней постменопаузе, когда масса губчатого вещества позвоночных отростков снижается в год на 5%, а кортикального слоя - на 1,5%. В развитии возрастного ОП паратгормон выполняет роль медиатора. Изменения в минеральном гомеостазе и дефицит костной ткани развиваются на фоне снижения функции паращитовидных желез, эндокринной функции почек и других проявлении возрастной инволюции.
Клиническая картина
Остеопороз развивается постепенно и долгое время может оставаться незамеченным. Проявление характерных его симптомов достигает максимума приблизительно через 10-15 лет (Рис.16). Основными клиническими симптомами являются боли в костях, особенно часто в костях поясничного или грудного отделов позвоночника, которые могут трансформироваться в картину радикулита. Отмечается медленное уменьшение роста с соответствующими изменениями осанки, прогрессирующее ограничение двигательной активности позвоночника, потеря массы тела. Больные нередко в течение длительного времени лечатся без достаточного эффекта по поводу "радикулита", ошибочно диагностированной миеломной болезни, метастазов злокачественной опухоли, множественных травм позвоночника.
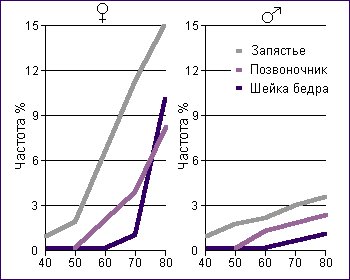
Рис. 16. Частота переломов костей предплечья, позвонков и шейки бедра у женщин различного возраста
Переломы являются поздними и наиболее яркими проявлениями остеопороза. Нередко переломы возникают в домашних условиях при падении с высоты роста. Наиболее часто отмечаются переломы лучевой кости, позвонков. Особенно трагичными являются переломы шейки бедра, смертность при которых наблюдается в 20-25% случаев в течение первых 6 месяцев, и тяжелая инвалидизация наступает в 40-45% случаев.
Диагностика остеопороза
1. Изучение анамнеза
2. Определение массы тела и роста
3. Определение минеральной плотности костной ткани
Однофотонные денситометры обычно используются для измерения минеральной плотности костей кисти, дистальных отделов костей предплечья или голени. Аппаратура данного класса проста в эксплуатации, мобильна, отличается малыми габаритами и малым весом, не требует отдельного помещения и длительной подготовки операторов. Продолжительность одного исследования (без анализа данных) составляет 5-10 минут. Однофотонные денситометры могут быть использованы для проведения скрининговых исследований.
Вместе с тем следует учитывать, что показатели минеральной плотности дистальных отделов костного скелета у значительного числа женщин в пери- и постменопаузе могут мало отличаться от нормы и не всегда отражают возрастные метаболические сдвиги.
Двухфотонная рентгеновская денситометрия основана на использовании модификации двухфотонных радионуклидных денситометров. Последние модели дают возможность исследовать любую кость и весь скелет в двух и более проекциях. Время обследования значительно сокращено за счет увеличения детекторов. Продолжительность исследования - 1-15 минут в зависимости от непосредственной задачи и модели прибора.
Количественная компьютерная томография. Основные недостатки этого метода связаны с затруднениями, возникающими при исследованиях мелких костей вследствие так называемого "эффекта парциальных объемов" и с относительно большой суммарной лучевой нагрузкой при длительных динамических наблюдениях.
Ультразвуковая денситометрия. Имеет преимущества при обследовании женщин в постменопаузе, так как на фоне дефицита эстрогенов первично поражаются трабекулярные кости. Объектом исследования обычно служит пяточная кость.
Рентгенодиагностика - информативна при потере массы костной ткани свыше 30%.
Для оценки активности процессов формирования и резорбции кости, а также при динамической оценке эффективности проводимого лечения прибегают к определению биохимических маркеров.
Маркеры резорбции кости:
- кальций/креатинин мочи;
- гидроксипролин/креатинин мочи;
- пиридолин и дезоксипиридолин мочи.
Маркеры образования костной ткани:
- сывороточный остеокальцин;
- изофермент щелочной фосфатазы;
- проколлагеновые пептиды.
Профилактика
Сохранение костной массы - задача более легкая, чем ее восстановление. В связи с этим особое значение приобретает профилактика остеопороза, которая должна осуществляться на протяжении всей жизни женщины. При этом следует уделять серьезное внимание формированию пиковой массы костной ткани и созданию скелета с максимальной прочностью к периоду полового созревания и предотвращению постменопаузального и возрастного дефицита минерального состава костной ткани.
Поскольку генетические детерминанты костной ткани предопределены, основное внимание следует уделять средовым факторам, периоду роста кости в юношеском возрасте, беременности, лактации и периоду перименопаузы.
Рекомендации для профилактики остеопороза:
- полноценное питание с достаточным потреблением содержащих кальций продуктов;
- физическая активность, "умение падать";
- исключение вредных привычек (курение, кофе, алкоголь);
- поддержание регулярного менструального цикла в репродуктивном возрасте;
- активная реклама предпочтения молочных напитков газированным;
- своевременное выявление групп риска;
- назначение витамина Д и добавок кальция, в т.ч. и у женщин старше 70 лет;
- профилактика прогрессирующего снижения пери- и постменопаузальных потерь костной ткани достигается также посредством назначения препаратов половых гормонов.
Общепринято, что в постменопаузе женщина должна получать 1200-1500 мг кальция в сутки, что предпочтительно компенсировать полноценной диетой. Самым естественным источником кальция являются молочные продукты. В случаях ферментной недостаточности, аллергии к молоку или проблем с липидами крови может быть использован таблетированный кальций. Витамин Д стимулирует всасывание кальция в кишечнике, снижает активность паратгормона и повышает активность процессов формирования кости.
Лечение
В связи с тем, что патогенез постменопаузального остеопороза довольно сложен и неоднозначен, лечение данного контингента больных ставит задачей блокаду процессов резорбции костной ткани и, одновременно, активацию процессов формирования кости.
Для лечения остеопороза используются:
I. Препараты половых гормонов:
- эстрогены + гестагены, в виде моно-, двух- и трехфазных препаратов;
- эстрогены + андрогены
- II. Кальцитонин
- III. Бифосфонаты
- IV. Витамин Д
- I. Механизм защитного влияния эстрогенов на костную ткань:
- активация синтеза кальцитонина;
- блокада активности паратгормона посредством снижения его синтеза или снижения чувствительности остеокластов;
- снижение чувствительности костной ткани к рассасывающему действию метаболитов витамина Д3;
- активация процессов гидроксилирования витамина Д3 в почках и превращения его в активную форму 1,25-дигидроксихолекальциферол;
- усиление всасывания кальция в кишечнике;
- снижение катаболического эффекта тироксина за счет усиления синтеза тиреоглобулина.
Оптимальные дозы эстрогенов для профилактики и лечения остеопороза:
- эстрадиол-валерат 2 мг в сутки;
- конъюгированные эстрогены - 0,625 мг.
- Защитное влияние гестагенов на костную ткань проявляется в виде прямого воздействия через специфические рецепторы на остеобластах и опосредованно путем блокады рецепторов к глюкокортикоидам и снижения их ингибиторного эффекта на костную ткань.
Противопоказания к проведению заместительной гормональной терапии при остеопорозе:
- опухоли матки, яичников и молочных желез;
- маточные кровотечения неясного генеза;
- острый тромбофлебит;
- острая тромбоэмболическая болезнь;
- тромбоэмболические расстройства, связанные с приемом эстрогенов;
- почечная и печеночная недостаточность;
- тяжелые формы сахарного диабета.
В ходе заместительной терапии каждые три месяца необходим контроль артериального давления, онкоцитологическое исследование, проведение один раз в год УЗИ гениталий и маммографии, регулярное участие пациенток в мини-лекциях и групповых дискуссиях о пользе и безопасности гормонотерапии.
Гормонотерапия в постменопаузе остается терапией выбора для профилактики и лечения постменопаузального остеопороза. Гормональная заместительная терапия оказывает положительное влияние на массу костной ткани. В рамках плацебоконтролируемого исследования показано, что после трехлетнего непрерывного лечения минеральный состав костей предплечья на 9% превышает таковой у женщин группы плацебо (Рис.17).
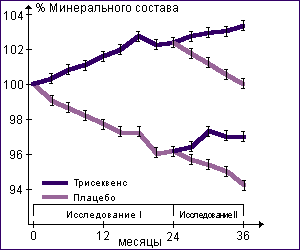
Рис. 17. Заместительная гормональная терапия способствует предотвращению потери массы костной ткани (данные плацебо - контролируемого исследования)
В целях профилактики остеопороза назначение гормональных препаратов показано на период времени в течение 5-8 лет постменопаузы. При проведении заместительной терапии не только прекращается потеря костной массы, но и возрастает минеральная плотность костной ткани как в позвоночнике, так и, что важно, в шейке бедра.
II. Кальцитонин (КТ) назначается в случаях верифицированного остеопороза при наличии противопоказаний к назначению половых гормонов или при негативном к ним отношении пациентки.
Основной биологический эффект КТ:
- тормозит резорбцию костной ткани за счет угнетения активности и уменьшения количества остеокластов;
- оказывает выраженный аналгезирующий эффект при болях в костях посредством взаимодействия с бета-эндорфинами;
- способствует репаративному формированию костей при переломах, блокируя распад коллагена;
- увеличивает поступление кальция и фосфора в кость.
Образование КТ в организме может быть стимулировано путем назначения тестостерона, эстрогенов, гестагенов и комбинированных эстроген-гестагенных препаратов. В клинической практике широко используется синтетический КТ, который активнее натурального в 20-40 раз (таблица 4).
Таблица 4
ДОЗИРОВКА МИАКАЛЬЦИКА ПРИ ОСТЕОПОРОЗЕ
Хроническая ноющая боль в поясничной области (начальный остеопороз) | Острые эпизоды болей вследствие переломов позвонков | Поддерживающая терапия (с целью увеличения костной плотности) |
В течение 3-х недель 50 ME п/к или в/м через день или интраназально
50 ME 2 раза в день.
| 100 МЕ/день п/к или в/м ежедневно в течение 1 недели, затем по 50 ME ежедневно или через день в течение 2-3 недель (в зависимости от ответной реакции пациента) или 50 ME п/к или в/м 10 дней, затем интраназально по 50 ME 2 раза в течение 2 недель | В течение 3 месяцев 50 ME п/к или в/м через день или интраназально 2 раза в день |
Больные должны ежедневно в дополнение к приему КТ получать 600-1200 мг кальция. Побочные реакции отмечаются в 10-30% случаев (тошнота, головокружение, полиурия, озноб, приливы).
III. Бифосфонаты (ксидифон) - активные аналоги пирофосфата, который блокирует процессы резорбции кости и назначается в дозе 5-7 мг/кг массы тела в течение 14 дней, один курс лечения в 3 месяца. По данным биохимических и денситометрических исследований определяется остановка резорбции кости. В высоких же дозах бифосфонаты могут блокировать минерализацию костей (!).
IV. Витамин Д3.
Биологическое действие его заключается в:
- стимуляции всасывания кальция и фосфора в кишечнике;
- одновременном воздействии на процессы резорбции и формирования костной ткани посредством блокады секреции паратгормона;
- увеличении концентрации кальция и фосфора в матриксе и стимулировании его созревания;
- воздействии на факторы роста, что способствует повышению прочности кости.
- Подбор дозы витамина Д3 проводится в течение первых двух недель под контролем уровня сывороточного кальция. В последующем необходим контроль кальциевого баланса каждые 2-3 месяца. Прием витамина Д показан пожизненно, поскольку это может служить эффективным способом профилактики старческого остеопороза.
Активация процессов формирования кости может быть достигнута путем назначения флюорида натрия, анаболических стероидов и активных форм витамина Д. Флюорид натрия в дозе 75 мг с добавлением кальция оказывает длительный анаболический эффект на костную ткань. Анаболические стероиды могут быть использованы при тяжелом остеопорозе у пожилых людей, однако, побочные эффекты (гирсутизм, снижение тембра голоса, повышение атерогенных фракции липидов и др.) ограничивают прием их в течение длительного времени.
Несмотря на разнообразие методов профилактики и лечения постменопаузального остеопороза, наиболее обоснованным методом воздействия с целью профилактики и патогенетически обоснованного лечения является использование препаратов половых гормонов.
Серьезным аргументом в пользу назначения заместительного гормонального лечения женщинам любого возраста с целью профилактики и лечения гормонодефицитных состоянии являются фактические данные о снижении на 50% риска переломов костей предплечья и шейки бедра после проведенного в течение первых 5-7 лет со времени менопаузы лечения.
В связи с важным медико-социальным значением проблемы постменопаузального остеопороза и значительных материальных затрат, связанных с лечением и реабилитацией больных с остеопорозом и костными переломами в современном обществе, особого внимания заслуживает проведение скрининговых обследований для выделения групп риска.
Проведение первого скрининга в 50 лет позволяет выделить три степени риска, обосновать необходимость гормонального воздействия и уточнить время повторного скрининга;
Скрининг в возрасте 70 лет дает возможность прогнозировать более точно степень риска к 80-летнему возрасту женщины.
Назад
У женщин перименопаузального возраста, страдающих КС, частота развития артериальной гипертензии возрастает до 52,4%. Это, в свою очередь, повышает риск развития ИБС в 3 раза, инсульта - в 7 раз. С каждым последующим десятилетием жизни частота смерти женщин от сердечно-сосудистых заболевании возрастает в 3-5 раз. В связи с тем, что в ближайшем будущем в современном обществе ожидается увеличение числа находящихся в постменопаузе женщин, проблема профилактики и лечения сердечно-сосудистых заболеваний приобретает еще большее значение.
Неблагоприятное влияние менопаузы на риск развития заболеваний сердца и сосудов, в частности ИБС, связывают с происходящими в переходном возрасте изменениями в липидном спектре крови в "атерогенном" направлении - снижением липопротеинов высокой плотности (ЛПВП) и повышением уровня липопротеинов низкой плотности (ЛПНП) и содержания холестерина. Эти изменения в условиях гипоэстрогении реализуются непосредственно на сердечно-сосудистую систему через рецепторы к эстрогенам, через влияние на биохимические процессы в эндотелии кровеносных сосудов и способствуют снижению секреции простациклина и повышению выработки тромбоксана.
Снижение уровня эстрогенных влияний приводит к увеличению резистентности стенок артериальных сосудов кровотоку и развитию микроциркуляторных нарушении.
Ожирение, изменение диетических привычек и недостаточно подвижный образ жизни в пери- и постменопаузе способствуют изменению толерантности к глюкозе и снижению чувствительности к инсулину (Рис.18).
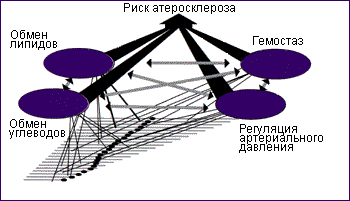
Рис. 18. Факторы риска развития атеросклероза
Факторы риска развития сердечно-сосудистых заболеваний
Обратимые:
- гиперхолестеринемия и нарушение спектра липопротеинов крови;
- ожирение;
- эндокринные нарушения: 1) гипоэстрогения; 2) сахарный диабет; 3) гипотиреоз;
- артериальная гипертензия;
- малоподвижный образ жизни и изменение диеты;
- курение;
- избыточное потребление алкоголя;
- стрессовые ситуации;
- повышение уровня фибриногена в плазме и изменение фактора-VII свертывания крови;
- неспецифические изменения ЭКГ в покое у женщин, не имеющих клинических признаков ИБС.
Необратимые:
- генетические факторы;
- повышающаяся с возрастом частота сердечно-сосудистых заболеваний.
Механизмы действия эстрогенов:
- Влияние на метаболизм липопротеинов. Снижение атерогенного профиля:
- стимуляция образования рецепторов к ЛПНП и ускорение распада частиц ЛПНП и их субфракций;
- повышение уровня ЛПВП, особенно фракции ЛПВП-2, -3;
- снижение уровня общего холестерина;
- снижение активности печеночной липопротеинлипазы и синтеза апопротеина А-1;
- антиоксидантный эффект на липиды;
- усиление обмена ЛПОНП.
- Прямое действие на рецепторы к эстрогенам, вазоактивные пептиды, простагландины, обменные процессы в соединительной ткани:
- снижение резистентности сосудистого кровотока;
- повышение индекса резистентности и индекса пульсации сосудов;
- увеличение секреции простациклина;
- снижение выработки тромбоксана;
- эффект антагониста кальция;
- повышение релаксирующего фактора эндотелия.
- Действие на углеводный обмен:
- повышение чувствительности к инсулину;
- увеличение секреции инсулина поджелудочной железой;
- нормализация теста на толерантность к глюкозе;
- снижение уровня глюкозы.
Изменения липопротеинов плазмы, вызванные наступлением менопаузы.
Еще совсем недавно было очень мало известно о том, как влияет наступление менопаузы на маркеры риска развития ишемической болезни сердца (ИБС), такие как липопротеиды плазмы.
Триглицериды, фосфолипиды и холестерин являются важными компонентами клеток всех органов и тканей. Они транспортируются в крови с апобелком в виде водорастворимых липопротеиновых комплексов.
Выделяют различные классы липопротеинов: хиломикроны и липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), липопротеины промежуточной плотности (ЛППП). ЛПВП предотвращают образование избытка холестерина (ХС), ЛПНП обеспечивают клетки холестерином при увеличении потребности в нем, и таким образом обеспечивается гомеостаз в норме.
Высокая концентрация ЛПНП, ЛППП и общего ХС положительно коррелирует с более ранним образованием атеросклеротических бляшек. С другой стороны, ЛПОНП выступают как фактор риска атеросклероза у пожилых женщин.
При низком уровне ЛПВП и повышении триглицеридов высок риск раннего инфаркта миокарда. Триглицеридемия связана с повышением тромбообразования и снижением фибринолитической активности. ЛПВП могут оказывать антиатерогенное действие с помощью обратного транспорта ХС из клеток печени, где он катаболизируется и в последующем выводится из организма.
Таким образом, отложению ХС в сосудистой стенке способствует высокий уровень ЛПОНП и ЛПНП, а ЛПВП (особенно ЛПВП-2 субфракции) оказывают противоположное антиатерогенное влияние. Однако, играют роль не столько абсолютные величины, сколько величина соотношения ЛПНП/ ЛПВП, т.е. коэффициент атерогенности. Низкое значение его является благоприятным.
Предполагают, что уровень ЛПОНП и ЛПВП в течение жизни остается довольно неизменным, в то время как содержание ЛПНП прогрессивно возрастает начиная с 30 лет. После 35 лет у мужчин отмечается резкий рост частоты заболевании сердечно-сосудистой системы, у женщин этот подъем замедляется защитным действием эндогенных эстрогенов. Но со снижением или прекращением функции яичников скорость возникновения этих заболевании быстро увеличивается, и к 60-70 годам ИБС касается в равной степени и мужчин, и женщин.
При гипоэстрогении резко возрастает уровень атерогенных фракции ЛП: происходит увеличение общих ЛП и ЛПНП и снижение ЛПВП (особенно ЛПВП-2, -3 субфракций). Уменьшение числа печеночных рецепторов к ЛПНП при этом является, вероятно, одним из ведущих факторов в механизме повышения концентрации ЛПНП в крови у женщин в постменопаузе.
Дополнительные методы исследования:
- Измерение артериального давления;
- Электрокардиограмма;
- Индекс Брея;
- Определение глюкозы и тест на толерантность к глюкозе;
- Биохимические параметры крови: ЩФ, АЛТ, ACT, креатинин, холестерин, триглицериды;
- Липидный спектр крови: ХС-ЛПВП, ХС-ЛПНП, ХС-ЛПОНП, субфракции ЛПНП, аполипопротеины, липопротеин-А;
- Гемостазиограмма - факторы свертывания крови, тромбоцитарное звено, определение простациклина, тромбоксана.
- Определение инсулина в крови;
- Исследование сосудистой резистентности, скорости кровотока в сердечной мышце и сонной артерии с помощью аппарата "Допплер".
По данным эпидемиологических исследований, гормональная заместительная терапия препаратами эстрогенных гормонов способствует снижению риска развития ИБС у женщин в постменопаузе на 30-40%, а у женщин с ангиографически верифицированными нарушениями коронарного кровообращения после перенесенного ранее инфаркта миокарда риск смерти от ИБС снижается на 80%. Существенно значимым фармакодинамическим эффектом эстрогенов является влияние на стенки артериальных сосудов - увеличение выработки простациклина, повышение уровня эндотелиального расслабляющего фактора, снижение периферического сосудистого сопротивления и увеличение кровотока. Это также может способствовать снижению вероятности развития ИБС у женщин, получающих в постменопаузе заместительную гормональную терапию (Таблица 5). Эти и другие механизмы, прямо или косвенно обусловливают положительное влияние на снижение сердечно-сосудистых заболевании у женщин в постменопаузе.
Таблица 5
Влияние эстрогенов на липидный баланс у женщин в постменопаузе
Липидный спектр | Без лечения | Заместительная терапия эстрогенами |
Общий холестерин | увеличение | без измен./уменьшение |
ЛПВП | без измен./уменьшение | увеличение |
ЛПНП | увеличение | уменьшение |
Триглицериды | увеличение | увеличение |
При выборе препарата для проведения заместительной гормональной терапии у женщин группы риска ИБС в постменопаузе следует руководствоваться структурой молекулы эстрогена, входящего в его состав, особенно у женщин с гипертриглицеридемией. Имеются данные, что назначение алкилированной или конъюгированной формы эстрогена может способствовать повышению уровня триглицеридов, тогда как этинил-эстрадиол подобного влияния не оказывает. Эффект эстрогенов связан также и со способом введения: при чрескожном введении, когда отсутствует прохождение соединения через печень, уровень содержания триглицеридов меняется в меньшей степени, чем при пероральном назначении препарата. Влияние на триглицериды зависит также от дозы эстрогенов.
Изменения липидов и липопротеинов крови при включении в заместительную терапию эстрогенами гестагенов.
В связи с повышением риска развития рака эндометрия при изолированном использовании эстрогенов в настоящее время считается целесообразным в большинстве случаев (за некоторыми исключениями) одновременно назначать гестагены (прогестины), уравновешивающие эффект эстрогенов на эндометрии. Так как гестагены добавляются только для предотвращения опухолей эндометрия, нет смысла применять их после удаления матки.
Окончательный метаболический эффект комбинированной заместительной терапии зависит от соотношения в комбинации между двумя типами стероидов. Преимущественно эстрогенная комбинация дает типичное для эстрогенов снижение липопротеинов низкой плотности и повышение содержания липопротеинов высокой плотности. Преимущественно гестагенная комбинация не изменяет уровень липопротеинов низкой плотности и снижает уровень липопротеинов высокой плотности.
Влияние на липиды зависит от типа прогестинов, дозы и путей введения. Вместе с тем, выбор "оптимального" гестагена для назначения женщинам группы риска ИБС в постменопаузе остается прерогативой будущих изысканий, особенно в связи с созданием препаратов новых поколений.
Одним из наиболее перспективных направлений в исследовании этой проблемы является изучение доставки прогестагена при помощи внутриматочного приспособления, так как введение стероида непосредственно в нужную ткань могло бы снизить системную циркуляцию прогестагена.
Серьезные изменения происходят в настоящее время в области применения гормональной заместительной терапии. Сами женщины, их медицинские консультанты, врачи общей практики, кардиологи и специалисты по липидному обмену считают гормональную заместительную терапию целесообразным методом лечения, направленным на снижение вероятности развития сердечно-сосудистых заболеваний в постменопаузе, хотя ранее этот метод применялся только с целью поддержания плотности костной ткани в период постменопаузы. Поэтому, вероятно, количество случаев назначения врачами гормональной заместительной терапии данной категории женщин будет увеличиваться. Имеющиеся на сегодняшний день данные, полученные в результате описанных исследований по первичной и вторичной профилактике ИБС, с веским основанием позволяют предполагать, что гормональная заместительная терапия способствует снижению летальности от сердечно-сосудистых заболеваний, а также смягчению тяжести эпизодов этого заболевания у женщин пери- и постменопаузального возраста.
Назад
Для женщин перименопаузального возраста без выраженных клинических проявлений менопаузального синдрома предлагается система балльной оценки для уточнения факторов пользы и риска, позволяющая без особых затруднений принять рациональное решение (Табл.6).
Таблица 6
Система балльной оценки для определения риска и пользы заместительной гормональной терапии для женщин без выраженных клинических проявлений постменопаузального синдрома
+ | 0 | - | ||
Возраст/время (годы) | ||||
При менопаузе: | 47-53
| 2
|
|
|
После менопаузы: | < 2
| 2
|
|
|
Состояние костной системы: | Семейный анамнез
| 2
|
|
|
Потеря костной ткани: | Отсутствует
|
| 0
|
|
Сердечно-сосудистые заболевания: | Имеются
| 2
|
|
|
Рак молочной железы: | 1 родственница < 60 лет
|
|
| 6
|
Всего: |
Заместительная гормональная терапия может быть рекомендована, если сумма баллов по шкале (+) окажется > 5.
Абсолютными противопоказаниями для проведения заместительной гормональной терапии являются:
- рак молочной железы;
- рак эндометрия;
- коагулопатии;
- нарушения функции печени;
- тромбофлебит;
- маточное кровотечение неуточненного генеза.
При выраженных симптомах менопаузального синдрома алгоритм обследования включает систему последовательного обсуждения необходимых вопросов, связанных с характеристикой клинических проявлений, оценкой факторов риска, выявлением преимуществ заместительной гормональной терапии, отношением к этому методу лечения и профилактики самой пациентки, учетом репродуктивного анамнеза и статуса к моменту обследования и определением спектра дополнительных диагностических мероприятий (Таблица 7).
Таблица 7
Принципы консультирования женщин в постменопаузе и вопросы гормональной заместительной тепапии (ГЗТ)
Имеются ли симптомы? | Оценить факторы риска развития остеопороза | |
*Бессоница
| НЕТ => | *Ранняя менопауза
|
ДА | ОБСУДИТЬ ПРЕИМУЩЕСТВА ГЗТ
| |
ВЫЯСНИТЬ, НЕТ ЛИ:
| НЕТ | ЖЕЛАЕТ ЛИ ПАЦИЕНТКА НАЧАТЬ ГЗТ |
|
ДА | ||
НЕОБХОДИМОЕ ОБСЛЕДОВАНИЕ
| ||
ОБСУДИТЬ ВОЗМОЖНЫЕ МЕТОДЫ
| НЕТ | ИМЕЮТСЯ ЛИ ПРОТИВОПОКАЗАНИЯ К ГЗТ?
|
|
ДА | ||
ОБСУДИТЬ ДЛИТЕЛЬНОСТЬ ЛЕЧЕНИЯ И ЧАСТОТУ ОБСЛЕДОВАНИЙ
| ОБСУДИТЬ АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
| |
Показания к заместительной гормональной терапии:
- приливы жара
- ночные поты
- депрессии
- нарушения сна диспареуния
- сухость во влагалище
- учащенное мочеиспускание
- дизурия
- недержание мочи ишемическая болезнь сердца
- остеопороз
Особое место среди популяции женщин постменопаузального возраста, у которых выявлены несомненные показания к заместительной гормональной терапии, занимает когорта женщин с преждевременной (идиопатической или хирургической) менопаузой (до 40 лет) в связи с повышением у них риска инфаркта миокарда в 4-5 раз в сравнении с практически здоровыми женщинами аналогичного возраста, т.е. в возрастной группе, в которой ишемическая болезнь сердца встречается редко. Если же принять во внимание, что порог возникновения костных переломов у женщин группы риска достигается через 10-15 лет после прекращения функции яичников, то становится очевидным, что для женщин с преждевременной менопаузой этот период наступает уже в шестом десятилетии жизни.
Продолжительность лечения
Кратковременная и средней продолжительности стратегия для устранения симптомов:
- лечение на протяжении 2-3 лет для устранения симптомов с постепенным выходом из лечебной программы при условии обратного развития симптомов;
- при возобновлении симптомов после отмены ЗГТ лечение продолжают до окончательного достижения благоприятных результатов и устранения симптомов;
- при желании пациентки продолжать лечение после устранения симптомов при достижении хорошего самочувствия и/или в связи с семейным риском остеопороза и сердечно-сосудистых заболевании при благоприятных обстоятельствах лечение может быть продолжено в аналогичном режиме до 3-8 лет, после чего необходим пересмотр стратегии.
Долговременная стратегия:
- принятие первоначального решения о продолжительности лечебного воздействия не менее 5-ти и, возможно, до 10-ти лет.
Прекращение лечения возможно на фоне любого режима
Условия:
- постепенное снижение дозы эстрогенного компонента на протяжении нескольких месяцев;
- повышение дозы прогестагенов на фоне снижения эстрогенного дозового режима.
Выбор режима заместительной гормональной терапии
Определение химической структуры эстрогенного компонента:
- "Натуральные"
- 17бета-эстрадиол
- эстрадиол валерат
- конъюгированные эквининовые эстрогены (эквилин+17альфа-дигидро-эквилинин)
- эстриол
- Синтетические аналоги
- этинил-эстрадиол
- местранол
Желательно обеспечение пременопаузального уровня эстрогенов в плазме периферической крови. При этом достигается значительное облегчение или полное устранение симптомов и одновременно реализуется защитный эффект по отношению к костной ткани. Вместе с тем, дозовый режим, обеспечивающий облегчение симптомов климактерического синдрома не защищает от остеопороза!!!
Выбор дозы должен быть соразмерен со скоростью метаболического превращения в организме и инактивации. В отличие от 17-бета-эстрадиола и эстрадиола валерата конъюгированные эстрогены подвергаются более быстрой инактивации в печени, тогда как эстриол вследствие быстрой глюкуронизации оказывает слабый системный эффект.
Суточные дозы 17-бета-эстрадиола или эстрадиола валерата при пероральном применении обычно составляют 1-4 мг; аналогичный клинический эффект при оральном приеме конъюгированных эстрогенов достигается при назначении дозы 0,625-1,25 мг; суточная доза 17-бета-эстрадиола при чрескожном введении - 0,05-0,1 мг.
После 60-летнего возраста суточная доза эстрогенов должна быть снижена в значительной степени в сравнении с предшествующим десятилетием жизни. Чрескожный путь введения предпочтителен при необходимости минимизации воздействия вводимых гормонов на функцию печени.
Непременное сочетание эстрогенного компонента с назначением прогестагенов в циклическом или непрерывном режиме.
Контингенты пациенток, нуждающихся в заместительной гормональной терапии:
- женщины перименопаузального возраста;
- женщины с преждевременным выключением функции яичников;
- женщины старшей постменопаузальной возрастной группы с системными нарушениями;
- женщины с отягощенным соматическим статусом.
Кровотечение отмены возникает обычно на 11-13 день от начала приема прогестагенов в циклическом режиме. Заслуживает внимания отсутствие связи между состоянием эндометрия, т.е. наличием или отсутствием гиперплазии, и началом кровотечения. Однако, неконтролируемые кровянистые выделения являются важным симптомом патологии эндометрия.
Назначение одних эстрогенов (без защиты прогестагенами) сопровождается развитием гиперплазии эндометрия у 15-30% женщин в зависимости от дозы и продолжительности лечения. В популяции женщин, не получающих заместительной гормональной терапии, частота развития гиперплазии эндометрия составляет 5%, рака эндометрия - 6,96/1000, т.е. 1,71/1000 женщино-лет. Последовательное назначение эстрогенов и гестагенов не повышает риска развития рака эндометрия.
При назначении заместительной гормональной терапии одними эстрогенами в течение двух лет частота гиперплазии эндометрия возрастает до 40%, при дополнительном назначении гестагенов частота развития гиперплазии эндометрия снижается до < 4%.
Динамический мониторинг состояния эндометрия:
- гинекологическое исследование;
- цитологическое исследование;
- ультразвуковой контроль влагалищным датчиком. Прогностическая ценность для злокачественной патологии эндометрия 71,1%, для доброкачественной - 95,6%. Критерием отсутствия патологии является толщина М-эхо < 6 мм.
- Относительный риск развития рака эндометрия при проведении заместительной гормональной терапии эстрогенами и прогестагенами на протяжении 10 лет находится в пределах от 0,9 до 1,3, тогда как в общей популяции (без ЗГТ) он равен 3,1.
Рак молочной железы
Проблема риска его развития не может считаться решенной окончательно. Отмечено некоторое повышение относительного риска после 10 лет непрерывной заместительной гормональной терапии.
Контроль и самоконтроль заместительной гормональной терапии
Самоконтроль - основа успешного лечения и профилактика прогрессирования системных нарушений.
Система самоконтроля включает:
ориентацию женщин старших возрастных групп в вопросах физиологии климактерического периода и патофизиологии системных нарушении периода постменопаузы; ориентацию женщин переходного и перименопаузального возраста в вопросах пользы и риска заместительной гормональной терапии; ориентацию в методах возможного самоконтроля и систем врачебного мониторинга женщин, получающих заместительную гормональную терапию. В Научный центр акушерства, гинекологии и перинатологии РАМН Вы можете обращаться по всем вопросам специализированной гинекологической помощи женщинам переходного возраста и повышения квалификации специалистов. Заместительная гормональная терапия компании Ново Нордиск
Главной заботой компании Ново Нордиск, как ведущего производителя гормональных препаратов, является безопасность и эффективность наших лекарственных средств. С этой целью более 14 % нашего годового оборота расходуется на научные исследования и разработки.
Мы добились значительных результатов.
Мировое лидерство в комбинированной заместительной гормональной терапии 7,9 млн. пациентов/год - свидетельство о нашем опыте и надежности препарата > 1,5 млн. пациентов на сегодняшний день
Удобная упаковка в виде календарного диска. Одна таблетка. Один раз в день. Каждый день.
- Безболезненные роды
- Беременность и секс
- Беременность после 35 лет. Радости, опасности, ловушки
- Если Вам нужен ребенок...
- Кормление грудью и курение
- Мифы о деторождении
- Муж и жена одна...
- Незапланированная беременность: проблема выбора
- Новые причины мужского бесплодия
- Психология младенца или что нужно знать будущей маме
- Рожайте снова через 18 месяцев!
- Страсти по прививкам
- Секс после родов
- Хочешь родить здорового ребенка - бросай курить!
- Эмбрион имеет право
- Эмоциональное состояние и бесплодие
- Чужая кровь
- Все, что вы хотели знать о гормонах.
- В США создан контрацептив в форме пластыря
- Контрацепция
- Мифы о гормонах ( предохранение от беременности)
- Принципиально новый метод контрацепции
- Знать все о своей груди
- Секс во время беременности
- Гармония, красота и здоровье для женщин старше 40
- Контрацепция в пре-менопаузе и климактерическом периоде
- Менопаузальный синдром
- Мученицы и мучительницы
- Новый безболезненный тест выявляет рак груди
- Поздняя Осень?
- Страдания по расписанию
- Сколько стоит девственность?

Сайт может содержать материалы, не предназначенные для лиц младше 18 лет.
Связаться с нами
Разработка и поддержка OOO "ИЦ КОМКОН"





 В России приступают к клиническим исследованиям нового лекарственного препарата
В России приступают к клиническим исследованиям нового лекарственного препарата
 Повышенный риск рака у женщин с эндометриозом
Повышенный риск рака у женщин с эндометриозом Переизбыток этого витамина может спровоцировать умственную отсталость
Переизбыток этого витамина может спровоцировать умственную отсталость Недостаток сна может испортить зрение
Недостаток сна может испортить зрение Опасность употребления виноградного сока
Опасность употребления виноградного сока Болезни на которые указывают потные ладони
Болезни на которые указывают потные ладони Риск окклюзионных заболеваний периферических артерий увеличивается при недостатке сна
Риск окклюзионных заболеваний периферических артерий увеличивается при недостатке сна Cписок продуктов, которые опасно хранить в холодильнике
Cписок продуктов, которые опасно хранить в холодильнике 6 скрытых опасностей йогуртов
6 скрытых опасностей йогуртов